«Año de la Inversión
para el Desarrollo Rural y la Seguridad Alimentaria»
· Integrantes: peña palomino
Juliana.
Alban Mauricio pablo.
Ocaña Alvarado Jorge.
Machado morales Carmen.
Litano silupú greicy.
· Curso: Ciencia Tecnología y Ambiente.
· Tema: HERRAMIENTAS DEL METABOLISMO.
· Profesora: Laurentina Astutillo Agurto.
· Grado/sección: 4 “B”
· I.E: José Carlos Mariátegui.
2013
Herramientas del metabolismo:
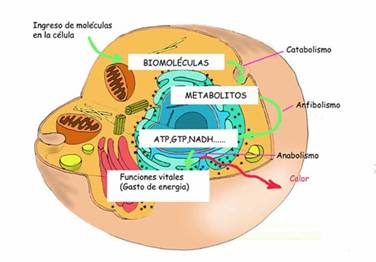
En todas las reacciones químicas que ocurren en la naturaleza se produce una transformación de sustancias de sustancias iníciales - llamadas sustratos- en sustancias finales –llamados productos-. La velocidad de estas reacciones debe ser tal que resulte útil para los sistemas vivos. Para esto es necesario que el sustrato se “active”, de forma que sus enlaces se debiliten para facilitar su ruptura. Este paso se conoce como complejo activado. Para formar el complejo activado se requiere energía. Esta energía se obtiene por elevación de la temperatura o invirtiendo mucho tiempo para conseguir la energía necesaria.
Las enzimas:
En nuestras células existen unas proteínas especiales, llamadas enzimas, que se encargan de disminuir la energía que necesita el sustrato para transformarse en producto.
Las enzimas pueden actuar de dos formas: fijándose a través de enlaces fuertes al sustrato para debilitar sus enlaces y disminuir la demanda de energía necesaria para romperlos, o atrayendo los sustratos a su superficie para aumentar la posibilidad de encuentros y facilitar la reacción.
Características de las enzimas:
Las enzimas son conocidas como biocatalizadores porque pueden compararse con los catalizadores inorgánicos, sustancias que aceleran la velocidad de las reacciones entre los sustratos. Las enzimas tienen, además, características que las distinguen de los catalizadores inorgánicos: son muy específicas, actúan a temperatura ambiente, pueden aumentar la velocidad de la reacción de un millón a un trillón de veces y trabajan en condiciones de temperatura y acidez particulares.
Muchas enzimas solo trabajan en presencia de una sustancia adicional, que puede ser orgánica o inorgánica. Si la sustancia es orgánica se denomina coenzima. Las vitaminas son el mejor ejemplo. Si la sustancia es inorgánica se denomina cofactor; es el caso de algunos minerales como el zinc, el cobre, el hierro o el manganeso.
Más datos:
El nombre de la enzima generalmente consta de dos términos: uno hace referencia al sustrato sobre el que esta actúa y el otro es el sufijo –asa. Así, por ejemplo, las enzimas que degradan proteínas se denominan proteasas; las que actúan sobre los lípidos, lipasas, y las de los glúcidos, glucosidasas.
Las moléculas de ATP:
Las células necesitan un suplemento constante de energía para mantener su organización y funcionamiento. Esa energía es obtenida principalmente por la degradación de las moléculas orgánicas del alimento.
Mientras tanto, la energía liberada en esa degradación no se usa directamente en las actividades celulares sino que es transfería a las moléculas de una sustancia almacenadora de energía: el adenosín trifosfato (ATP). Las moléculas de ATP son almacenes temporales de energía en la célula y actúan como una “moneda energética” con la cual la célula la “paga” las necesidades de energía que se requiere en los procesos celulares. Todos los seres vivos utilizan moléculas de ATP en sus células
El ATP es un nucleótido (similar al que conforman los ácidos nucleicos) compuesto por una molécula de adenina (base nitrogenada), el azúcar ribosa y tres fosfatos.
El ATP: formación y degradación:
Las moléculas de ATP se forman y almacenan energía en sus enlaces fosfatos, tomada de la energía liberada al romperse los enlaces de las moléculas orgánicas (glucosa generalmente) de los alimentos. En ese proceso, parte de la energía liberada es utilizada por una molécula semejante al ATP, pero formada por dos fosfatos: el ADP (adenosín difosfato), que incorpora un grupo fosfato para formar el ATP. Esa reacción consume energía.
Cuando una actividad celular necesita de energía, el ATP es degradado en ADP y Pi y parte de la energía liberada en esa reacción es utilizada para suplir la demanda energética de la célula.
Función del ATP: moneda energética.
Las reacciones catabólicas liberan energía que se almacena en las moléculas de ATP. La célula utiliza esa energía almacenada para realizar trabajos como la fabricación de proteínas, el transporte de sustancias a través de la membrana, la contracción muscular, etc.
En todas las reacciones químicas que ocurren en la naturaleza se produce una transformación de sustancias de sustancias iníciales - llamadas sustratos- en sustancias finales –llamados productos-. La velocidad de estas reacciones debe ser tal que resulte útil para los sistemas vivos. Para esto es necesario que el sustrato se “active”, de forma que sus enlaces se debiliten para facilitar su ruptura. Este paso se conoce como complejo activado. Para formar el complejo activado se requiere energía. Esta energía se obtiene por elevación de la temperatura o invirtiendo mucho tiempo para conseguir la energía necesaria.
Las enzimas:
En nuestras células existen unas proteínas especiales, llamadas enzimas, que se encargan de disminuir la energía que necesita el sustrato para transformarse en producto.
Las enzimas pueden actuar de dos formas: fijándose a través de enlaces fuertes al sustrato para debilitar sus enlaces y disminuir la demanda de energía necesaria para romperlos, o atrayendo los sustratos a su superficie para aumentar la posibilidad de encuentros y facilitar la reacción.
Características de las enzimas:
Las enzimas son conocidas como biocatalizadores porque pueden compararse con los catalizadores inorgánicos, sustancias que aceleran la velocidad de las reacciones entre los sustratos. Las enzimas tienen, además, características que las distinguen de los catalizadores inorgánicos: son muy específicas, actúan a temperatura ambiente, pueden aumentar la velocidad de la reacción de un millón a un trillón de veces y trabajan en condiciones de temperatura y acidez particulares.
Muchas enzimas solo trabajan en presencia de una sustancia adicional, que puede ser orgánica o inorgánica. Si la sustancia es orgánica se denomina coenzima. Las vitaminas son el mejor ejemplo. Si la sustancia es inorgánica se denomina cofactor; es el caso de algunos minerales como el zinc, el cobre, el hierro o el manganeso.
Más datos:
El nombre de la enzima generalmente consta de dos términos: uno hace referencia al sustrato sobre el que esta actúa y el otro es el sufijo –asa. Así, por ejemplo, las enzimas que degradan proteínas se denominan proteasas; las que actúan sobre los lípidos, lipasas, y las de los glúcidos, glucosidasas.
Las moléculas de ATP:
Las células necesitan un suplemento constante de energía para mantener su organización y funcionamiento. Esa energía es obtenida principalmente por la degradación de las moléculas orgánicas del alimento.
Mientras tanto, la energía liberada en esa degradación no se usa directamente en las actividades celulares sino que es transfería a las moléculas de una sustancia almacenadora de energía: el adenosín trifosfato (ATP). Las moléculas de ATP son almacenes temporales de energía en la célula y actúan como una “moneda energética” con la cual la célula la “paga” las necesidades de energía que se requiere en los procesos celulares. Todos los seres vivos utilizan moléculas de ATP en sus células
El ATP es un nucleótido (similar al que conforman los ácidos nucleicos) compuesto por una molécula de adenina (base nitrogenada), el azúcar ribosa y tres fosfatos.
El ATP: formación y degradación:
Las moléculas de ATP se forman y almacenan energía en sus enlaces fosfatos, tomada de la energía liberada al romperse los enlaces de las moléculas orgánicas (glucosa generalmente) de los alimentos. En ese proceso, parte de la energía liberada es utilizada por una molécula semejante al ATP, pero formada por dos fosfatos: el ADP (adenosín difosfato), que incorpora un grupo fosfato para formar el ATP. Esa reacción consume energía.
Cuando una actividad celular necesita de energía, el ATP es degradado en ADP y Pi y parte de la energía liberada en esa reacción es utilizada para suplir la demanda energética de la célula.
Función del ATP: moneda energética.
Las reacciones catabólicas liberan energía que se almacena en las moléculas de ATP. La célula utiliza esa energía almacenada para realizar trabajos como la fabricación de proteínas, el transporte de sustancias a través de la membrana, la contracción muscular, etc.